- Présentation
- Recherche
- DGG : Département Génomique et Génétique du Développement
- REGARN : Les ARN non-codants, des acteurs de la plasticité développementale de la racine
- ChromD : Dynamique des chromosomes
- SILEG : Voies de signalisation contrôlant le développement du système racinaire des légumineuses
- FLOCAD : Développement floral et déterminisme du sexe
- Qlab : Equipe Génomique et épigenomique quantitative des plantes
- DPHYS : Département Physiologie et Signalisation
- PMIN : Département Interactions Plantes Micro-organismes et Réseaux
- DGG : Département Génomique et Génétique du Développement
- Enseignement
- Plateformes
- Bases de données
Symbiose et immunité chez les légumineuses
Équipe SYMUNITY / Pascal Ratet
Caractérisation de mutants symbiotiques affectés dans l’immunité
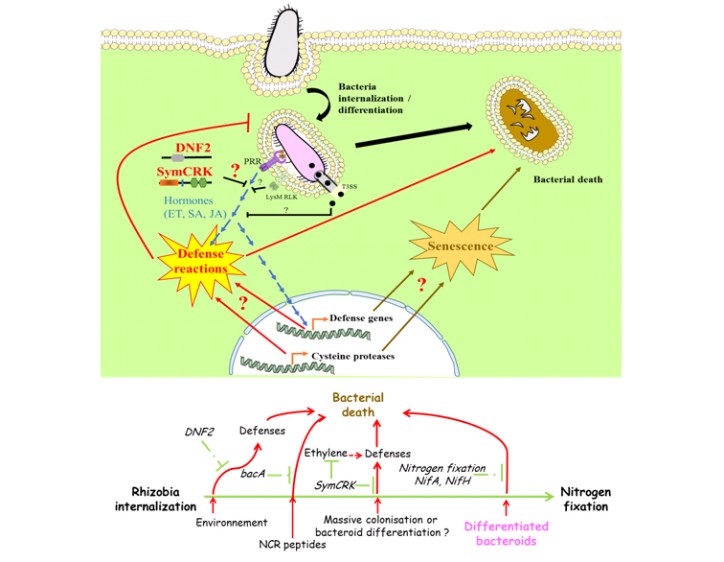
DNF2 est nécessaire à la survie des bactéries dans les nodosités (Bourcy et al., 2013b ; Berrabah et al., 2014a)
Nous avons précédemment identifié et caractérisé le gène DNF2 qui code pour une protéine de type phosphatidylinositol -phospholipase C à domaine X. Les plantes mutantes dnf2 développent des nodosités qui sont correctement envahies par les rhizobia pendant les premières étapes de la symbiose mais dans lesquelles le processus symbiotique s'interrompt dès que les bactéries sont libérées dans les cellules végétales. Cet arrêt du processus symbiotique s'accompagne de réactions de défense dans les nodosités et de la nécrose des nodosités, qui ne sont alors plus capables de fixer l’azote (nodosités fix-) Figure 3. Le phénotype de ce mutant dnf2 révèle un nouvel aspect de l'interaction symbiotique impliquant un contrôle des défenses de la plante dans les étapes tardives de la symbiose (Figure 4). DNF2 interviendrait ainsi dans un processus actif de répression de l’immunité des cellules végétales au sein des nodosités pour permettre la mise en place et la survie des symbiosomes.
_489x724.jpg)
SymCRK est nécessaire à la répression de l'immunité (Berrabah et al., 2014b ; Berrabah et al., 2018b)
Le gène SymCRK a été isolé car il présente un profil transcriptionnel très similaire à celui du gène DNF2, suggérant une possible co-régulation et une fonction proche codée par ces deux gènes. Le gène SymCRK code pour un récepteur de type RLK (receptor-like kinase). Les nodosités du mutant symCRK ont un phénotype similaire à celui de dnf2, avec des nodosités nécrotiques fix- (Figure 3). Nos travaux montrent que SymCRK est nécessaire pour supprimer les réactions de défense dans les nodosités, notamment en inhibant la voie de signalisation de l'éthylène, une phytohormone majeure de l’immunité (Berrabah et al., 2018b) (Figure 4).
L’utilisation de ces deux lignées mutantes de M. truncatula en combinaison avec des mutants du rhizobium, nous a permis de montrer que l’infection chronique par rhizobium est contrôlée à de multiples étapes pendant la symbiose (Berrabah et al., 2015 ; Figure 4).
Dans le but de compléter ce modèle (Figure 4), d’autres mutants de M. truncatula, présentant également des nodosités nécrotiques, (similaires à ceux décrit dans la littérature par d’autres équipes de recherche : Pislariu et al., 2012 ; Domonkos et al., 2017)ont été identifiés au laboratoire. Nous caractérisons actuellement ces mutants qui nous permettront certainement de découvrir de nouveaux acteurs de l’immunité ou de son contrôle lors de la mise en place de la symbiose.
Rôles des hormones de défense dans l’immunité et la symbiose
L'acide salicylique (SA), l'acide jasmonique (JA) et l'éthylène sont des phytohormones importantes, notamment impliquées dans le déclenchement des réactions de défense des plantes au niveau des racines et/ou des feuilles vis-à-vis des microorganismes pathogènes. L'éthylène intervient également à différents stades des interactions symbiotiques avec les rhizobia. Quelques travaux indiquent que les signalisations impliquant le SA et le JA seraient finement contrôlées pour permettre la mise en place de la symbiose. Cependant, les acteurs de ces voies de signalisation ainsi que les réponses spécifiques de défense associée sont encore très mal connus chez les légumineuses. Nous avons entrepris une approche génétique pour étudier le rôle de la signalisation du SA pendant la symbiose chez Medicago et le pois. De même, nous isolons les mutants de la voie de signalisation du JA chez Medicago. Ces outils génétiques nous permettront de mieux comprendre l’implication de ces grandes voies hormonales dans l’induction des défenses observées chez les mutants symbiotiques, comme dnf2 et symCRK, et ainsi de mieux comprendre l’importance de leur contrôle pour la mise en place de la symbiose. A terme, ce travail pourra apporter des informations sur la façon dont les légumineuses différencient et adaptent leurs réponses aux microorganismes symbiotiques versus pathogènes.
Sénescence et immunité
La sénescence intervient dans le programme de développement des nodosités (figure 4) et peut être contrôlée par des facteurs externes, comme les stress abiotiques et la nutrition azotée. Plusieurs études indiquent un lien entre sénescence et immunité. Les nodosités des mutants symCRK et dnf2 présentent des réactions de défense importantes mais également une sénescence précoce (Bourcy et al., 2013b ; Berrabah et al., 2014b). Il a été proposé que la suppression de l'immunité dans les nodosités soit levée lors de la mise en place du programme de sénescence dans les cellules de nodosités.
Nous abordons la question du lien entre la sénescence et l'immunité pendant la symbiose, en tirant parti des outils mutants décrits précédemment. Nous caractérisons actuellement de nouveaux mutants fix-, de Medicago qui développent ou non des réactions de défense et montrent une sénescence accélérée des nodosités. Un rôle de l'acide salicylique dans le processus de sénescence est également possible.
Endophytes et symbiose
Dans les champs, les nodosités des légumineuses n'abritent pas seulement des rhizobia mais aussi d’autres bactéries endophytes non rhizobiennes. Dans certaines plantes, il y a plus d'endophytes non rhizobiens dans les nodosités que de rhizobia et il existe une certaine spécificité du microbiome nodulaire. Cela suggère un choix par la plante des bactéries hébergées et/ou une compatibilité avec le partenaire rhizobien. Les déterminants symbiotiques et immunitaires gouvernant ces interactions sont méconnus.
Nous avons isolé de nodules une bactérie atypique (Ensifer adhaerens T4) qui se comporte comme un agent pathogène ou induit des nodosités chez la même espèce, Medicago truncatula. L’issue de l’interaction dépend de l’âge de l’hôte. T4 peut également co-coloniser des nodosités induites par une autre souche.
Dans le cadre d’un projet ANR, en collaboration avec B. Gourion et F. Vailleau (INRAE Toulouse) et la startup iMean (Toulouse), nous souhaitons mieux décrire les interactions pathogène et symbiotique-like de ce système, puis en intégrant les données génomiques (séquence du génome de T4 connue) et physiologiques de la souche, construire un modèle du fonctionnement du génome de T4. Ce model sera confronté aux données omics produites pour prédire les gènes clés de l’interaction T4-Medicago. Nous étudierons aussi la réponse de la plante lors des interactions symbiotique-like et pathogène avec la souche T4. Ce projet (PATHOSYM) permettra de mieux comprendre comment la plante différencie agents pathogènes et symbioses.
