- Présentation
- Recherche
- DGG : Département Génomique et Génétique du Développement
- REGARN : Les ARN non-codants, des acteurs de la plasticité développementale de la racine
- ChromD : Dynamique des chromosomes
- SILEG : Voies de signalisation contrôlant le développement du système racinaire des légumineuses
- FLOCAD : Développement floral et déterminisme du sexe
- Qlab : Equipe Génomique et épigenomique quantitative des plantes
- DPHYS : Département Physiologie et Signalisation
- PMIN : Département Interactions Plantes Micro-organismes et Réseaux
- DGG : Département Génomique et Génétique du Développement
- Enseignement
- Plateformes
- Bases de données
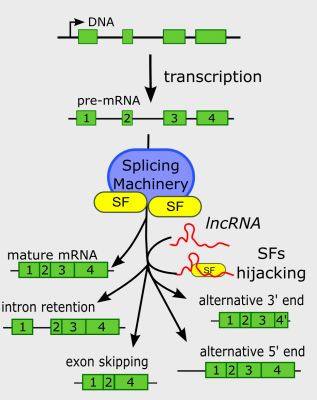
Régulation de l’épissage par des ARN longs non codants
Au cours des dernières années, l'avènement de nouvelles techniques de séquençage a permis d'identifier des milliers d'ARN qui s'expriment tout au long du génome et qui ne semblent pas coder pour les protéines comme le font les ARNm habituels (sauf quelques cas bien caractérisés comme les ARN ribosomaux et de transfert).
Ces ARN non codants, une sorte de "matière noire" du génome, ont été liés à un large éventail de mécanismes régulateurs contrôlant l'expression des ARNm codant pour les protéines, tels que la stabilité des ARNm, la répression translationnelle ou les interactions avec les mécanismes transcriptionnels et chromatiniques. Récemment, un nouveau lien entre l'épissage de l'ARN non codant et l'épissage de l'ARNm est en train d'émerger.
L'épissage est le processus par lequel les introns, segments non codants d'un ARNm, sont retirés de la transcription initiale afin d'obtenir un ARNm mature capable d'être traduit en protéine. Dans certaines circonstances, les réactions d'épissage peuvent être modulées en générant deux ou plusieurs isoformes d'ARNm à partir d'un seul pré-ARNm par un processus appelé épissage alternatif. Ensuite, l'épissage alternatif peut augmenter la plasticité du protéome eucaryote.
Dans une revue récente, Romero-Barrios et ses collègues d'IPS2 à Paris Saclay et d'IAL en Argentine, discutent des découvertes récentes sur les différents mécanismes par lesquels les ARN longs et petits non codants modulent l'épissage alternatif. Ces analyses leur ont permis de classer ces mécanismes selon les points communs et les singularités de leur interaction avec les machines d'épissage, leur association directe avec les pré-ARNm, leur rôle dans les processus de localisation nucléaire ou leur impact sur la conformation chromatinienne et la régulation épigénétique de la transcription.
Par conséquent, les ARN non codants peuvent affiner le processus d'épissage afin d'élargir l'ARNm et, par conséquent, la diversité protéique dans les organismes vivants et peuvent définir de nouvelles stratégies biotechnologiques pour réguler l'expression génétique des eucaryotes.