- Présentation
- Recherche
- DGG : Département Génomique et Génétique du Développement
- REGARN : Les ARN non-codants, des acteurs de la plasticité développementale de la racine
- ChromD : Dynamique des chromosomes
- SILEG : Voies de signalisation contrôlant le développement du système racinaire des légumineuses
- FLOCAD : Développement floral et déterminisme du sexe
- Qlab : Equipe Génomique et épigenomique quantitative des plantes
- DPHYS : Département Physiologie et Signalisation
- PMIN : Département Interactions Plantes Micro-organismes et Réseaux
- DGG : Département Génomique et Génétique du Développement
- Enseignement
- Plateformes
- Bases de données
Une nouvelle régulation des thiorédoxines plastidiales
Les adénylates régulent l’action des thiorédoxines via la liaison à une protéine à domaine CBS dans les plastes d’Arabidopsis.
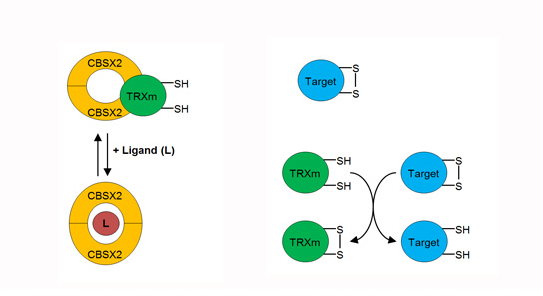
Deux équipes de l'IPS2 (CCARS et OGE) ont récemment collaboré et publié dans Plant Physiology une étude qui révèle un nouveau mode de régulation du contrôle redox dans le chloroplaste, mettant en jeu une interaction entre les thiorédoxines (TRXs) et une protéine cystathionine--synthase (CBSX). Les domaines CBS sont des senseurs d’énergie régulant l’activité de protéines grâce à leur capacité de liaison avec des ligands adénosyls. Les TRXs sont des oxydo-réductases de ponts disulfures impliquées dans la régulation redox de nombreuses activités enzymatiques, ainsi que dans la régénération de péroxydases à thiols. Nous avons montré que CBSX2 inhibe spécifiquement les fonctions des TRXs du type m. Les adénylates (ADP ou ATP) empêchent cet effet en abolissant l'interaction directe de CBSX2 avec la TRXm1/2 réduite. En utilisant des mutants ADN-T d'Arabidopsis, des analyses in planta ont permis de proposer un nouveau mécanisme de régulation des TRXs m permettant de maintenir un niveau d'énergie élevé dans le chloroplaste et une croissance optimale des plantes.
05/09/2022
